Laboratorio del corso di Biochimica del Metabolismo
Corso di Laurea in Biotecnologie
Produzione di una Proteina Ricombinante
Estrazione e purificazione della proteina ricombinanteLa sintesi della proteina, in questo particolare caso, è immediatamente evidente. La nostra SYFP ha infatti un colore giallo brillante che diventa evidente quando è illuminata con luce ultravioletta; i batteri che la producono, quindi, assumeranno le stesse caratteristiche. La purificazione prevede, nella sua prima fase, l'estrazione della proteina mediante lisi dei batteri, favorita da una sequenza di congelamenti e scongelamenti. Eliminati i detriti per centrifugazione (organelli e membrane), la YFP verrà a trovarsi nel sopranatante (frazione solubile) con una miriade di altre proteine batteriche dalle quali dovrà essere separata. Questa operazione, molto complicata in condizioni normali, è considerevolmente semplificata dalla presenza della coda di istidine che, grazie al particolare vettore utilizzato, è fusa all'estremità C-terminale della proteina. Questo peptide ha infatti la capacità di legare efficientemente alcuni ioni metallici, in particolare il nichel. Se questi ioni sono a loro volta fissati ad una matrice solida, la nostra proteina, attraverso l'amo di istidine, potrà agganciarsi ad essa. In sostanza, questo tipo di matrice potrà essere utilizzata per una cromatografia di affinità.
Informazioni utili
La figura che segue mostra la struttura dei gruppi che nella matrice coordinano lo ione metallico. Come si può notare, questa interazione è limitata solo ad alcuni dei legami possibili nella sfera di coordinazione; parte di essi restano ancora a disposizione delle molecole d'acqua.
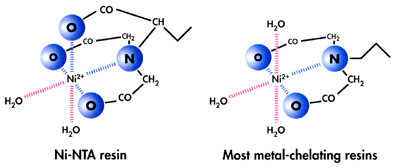
Fig. 7. Struttura dei gruppi chelanti costituenti
le matrici che legano metalli. |
Proprio queste ultime sono rimpiazzate dalle istidine presenti in coda alla proteina quando essa viene in contatto con la resina, secondo lo schema riportato qui sotto:
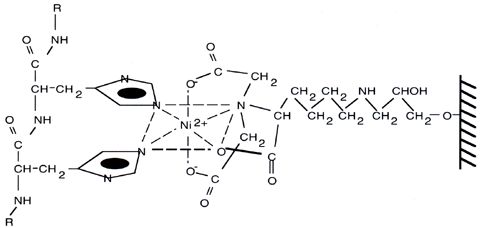
| Fig. 8. Interazione della coda di istidine con la resina Ni-NTA. Le due istidine a sinistra rappresentano la proteina legata alla matrice (a destra). |
Una situazione
simile è improbabile che si verifichi con le altre proteine batteriche
che costituiscono il lisato cellulare. Conseguentemente, la maggior parte
di esse non sarà trattenuta dalla colonna contenente la resina e potrà
essere lavata via. Dopo questo passaggio, infatti, la SYFP trattenuta conferirà
un colore giallo brillante alla matrice.
Il problema, dopo il lavaggio, è quello dell'eluizione, cioè
del distacco della proteina dalla resina. Per far questo bisogna interferire con l'interazione
delle istidine con lo ione metallico. Questo obiettivo si realizza aggiungendo
al tampone di lavaggio una molecola, l'imidazolo,
strutturalmente simile al gruppo che nell'istidina è responsabile dela
coordinazione.
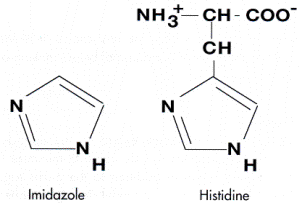
Fig. 9. Struttura dell'imidazolo
e dell'istidina. |
Anche se le due molecole, ipoteticamente, avessero la stessa capacità di legare il metallo, l'interazione con l'imidazolo può essere favorita semplicemente agendo sulla sua concentrazione nel tampone. Un aumento progressivo della concentrazione può addirittura essere sfruttato per eliminare eventuali impurezze legate alla possibilità che altre proteine batteriche, fra le migliaia presenti nel lisato di partenza, abbiano potuto interagire con la resina. Sarà, infatti, altamente improbabile che alcune di esse possano averlo fatto con la stessa forza della coda di istidine della SYFP.
Lo schema successivo, ottenuto dalla ditta che produce la resina che utilizzeremo, sintetizza la procedura appena discussa:
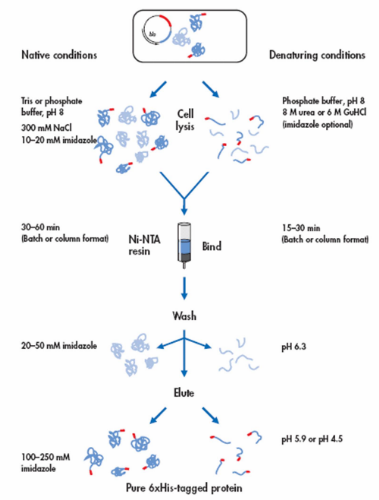
Fig. 10. Schema della procedura
di purificazione della proteina ricombinante. La coda di istidine
è indicata in rosso. Le impurezze sono mostrate con lo stesso colore della proteina di interesse ma senza la codina rossa. (Fonte:QIAGEN website ) |